在手术期间和术后48小时,监测大脑神经信号,对指导手术操作、评估术后神经系统并发症、降低围术期死亡率至关重要。相比于传统的微电极、场效应/薄膜晶体管,有机电化学晶体管(organic electrochemical transistors, OECT)由于其高跨导值、低驱动电压、良好的生物兼容性,更适用于下一代神经接口的开发。用于记录围术期脑活动的神经接口,OECT需要解决生物可降解性和多通道两个关键挑战。生物降解特性可避免二次移除手术带来的风险、潜在并发症和手术费用。另一个挑战是神经接口的数据样本量,即高密度和多通道阵列的OECT阵列。众所周知,生物体结构精密而复杂,尤其是大脑,在解剖学和功能上被划分为不同区域。因此,精巧设计OECT神经接口以实现更高的时空分辨率是必要的,从而使医生获得更准确的生理信息,为病人设计个性化的治疗策略。
近日,复旦大学宋恩名青年研究员联合电子科技大学于军胜教授、香港城市大学于欣格教授,报道了一种微米厚度、形态共融、可生物降解的神经接口,具备100个记录通道,用于短期监测脑皮层的电活动,其形式和功能明显区别于传统的神经接口技术。该神经接口结合了多种可生物降解的功能材料、连续微纳加工技术、集成策略,实现了细胞水平的脑活动映射和OECT阵列的最高通道记录。功能材料的低杨氏模量和超薄的厚度,使其能够无缝贴附在大脑皮层上,降低界面阻抗和运动伪影,高保真地映射实时的神经信号,实现了1.42毫秒和20微米的高时空分辨率,以及高达37分贝的信噪比。将其植入到大鼠的脑皮质层表面,记录了波形、时空和频域特征,成功区分大鼠在麻醉、癫痫发作和电刺激时的不同生理状态,证明了该神经接口在临床诊断和脑科学研究中的巨大应用潜力。同时,该神经接口被设计为体内完全可降解的电子平台。无需任何外界触发事件,在执行完监测任务后,可主动降解为生物安全的单体和良性碎片。该可生物降解的瞬态电子技术有望作为神经系统疾病的诊断/治疗、及脑科学研究的一种高效便捷的工具。相关结果发表在Advanced Science上。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/advs.202300504
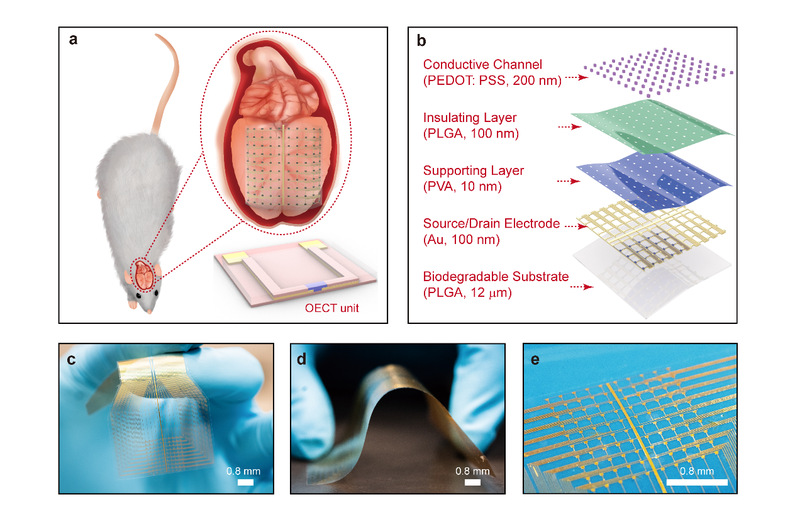
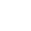
图1:超薄、柔性、多通道的瞬态OECT阵列用于制备高保真的神经接口。(a) 瞬态OECT阵列贴附在大鼠脑皮层上,用于记录micro-ECoG信号。(b) 可降解OECT阵列器件结构示意图,厚度约为15微米,重量为99.3毫克。8x8 mm2的活性区域包括100个OECT单元。(c),(d),(e) 光学图像用于展示生物可降解OECT神经接口的组织兼容的机械灵活性、超薄、高密度特征。
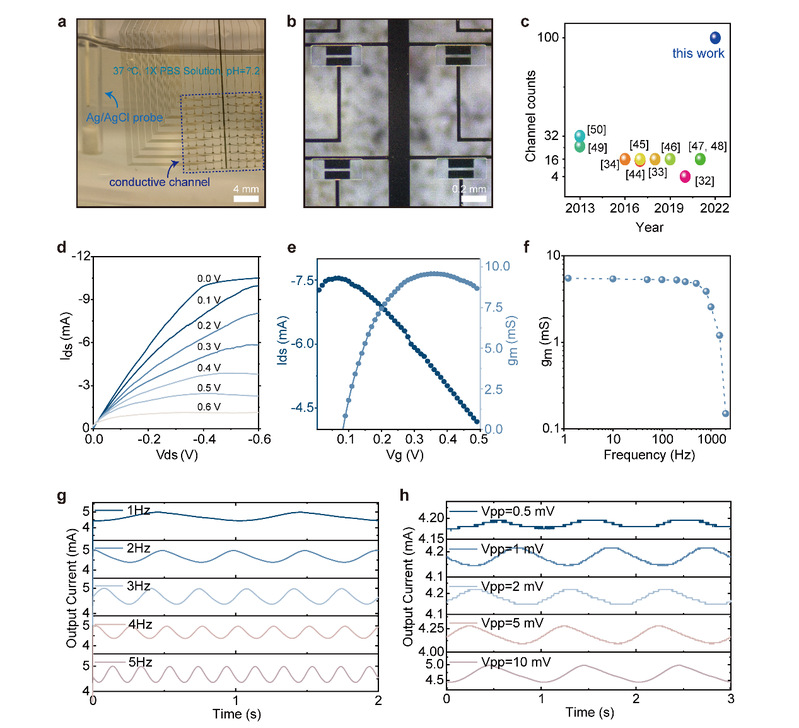
图2:可降解OECT阵列的体外性能表征。(a) 测量条件展示,OECT阵列浸泡在0.01M磷酸盐缓冲液中,温度为37 oC,pH=7.2,Ag/AgCl探针用作栅电极。(b) 器件光学显微照片。(c) 该工作和其他基于OECT的体内生物传感应用的通道数的比较结果。(d) OECT单元器件的输出特性曲线。(e)OECT单元器件的转移特性曲线。P型半导体PEDOT: PSS用作沟道材料,尺寸为200x20 mm2。(f) 跨导与栅电极频率的关系。栅极施加10 mV,频率为1 Hz至2 kHz的正弦波。漏极电压为-0.5 V。(g) OECT单元器件的输出信号与栅压频率的关系。(h) OECT单元器件的输出信号与栅压幅值的关系。
图3:多通道、瞬态OECT阵列工作机理表征。(a) OECT阵列在0.01 M磷酸盐缓冲液中的加速降解过程(pH=7.2,溶液温度=90 oC)。(b) OECT阵列在降解过程中产量的变化趋势。(c)随浸泡时间增加,OECT阵列总质量不断减少。(d) 表征PLGA(100 nm)、PLGA(12 mm)/PVA(10nm)/PLGA(100nm)的降解速度。(e) 感应耦合等离子体-光学发射光谱法,表征硫元素(源于PEDOT: PSS)和金元素浓度与浸泡时间的关系。(f) PEDOT: PSS的电化学阻抗的变化趋势。(b)-(f)中的数据是连续浸泡在0.01 M磷酸盐缓冲液中收集的(37 oC,pH=7.2)。(g) PEDOT: PSS的交联比例与跨导的关系。(h) PEDOT: PSS的交联比例与开态电流的关系。(g)-(h)中的数据是连续浸泡在0.01 M磷酸盐缓冲液中收集的(90 oC,pH=7.2)。
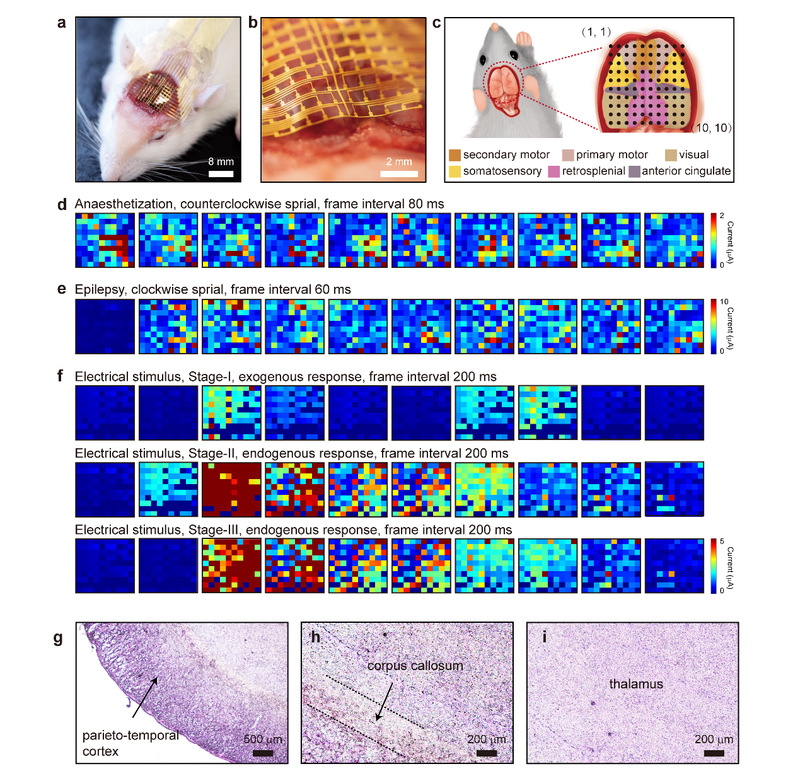
图4:生物可降解OECT神经接口的体内性能表征。(a) OECT阵列贴附在大鼠脑皮质层表面的俯视图。(b) OECT阵列贴附在大鼠脑皮质层表面的侧视图。(c) 大鼠脑组织功能区划分示意图,及OECT生物传感器在脑图谱上的位置标定。(d) 麻醉状态下的micro-ECoG信号映射,间隔为80 ms;(e) 癫痫发作时的micro-ECoG信号映射,间隔为60 ms;(f) 1 Hz、3 V电刺激下的micro-ECoG信号,间隔为80 ms。脑切片的苏木精-伊红染色结果: (g) 脑切片边缘,标记区为顶颞皮层;(h) 脑切片中间,标记区为胼胝体;(i) 大脑核心区域,标记区为丘脑。
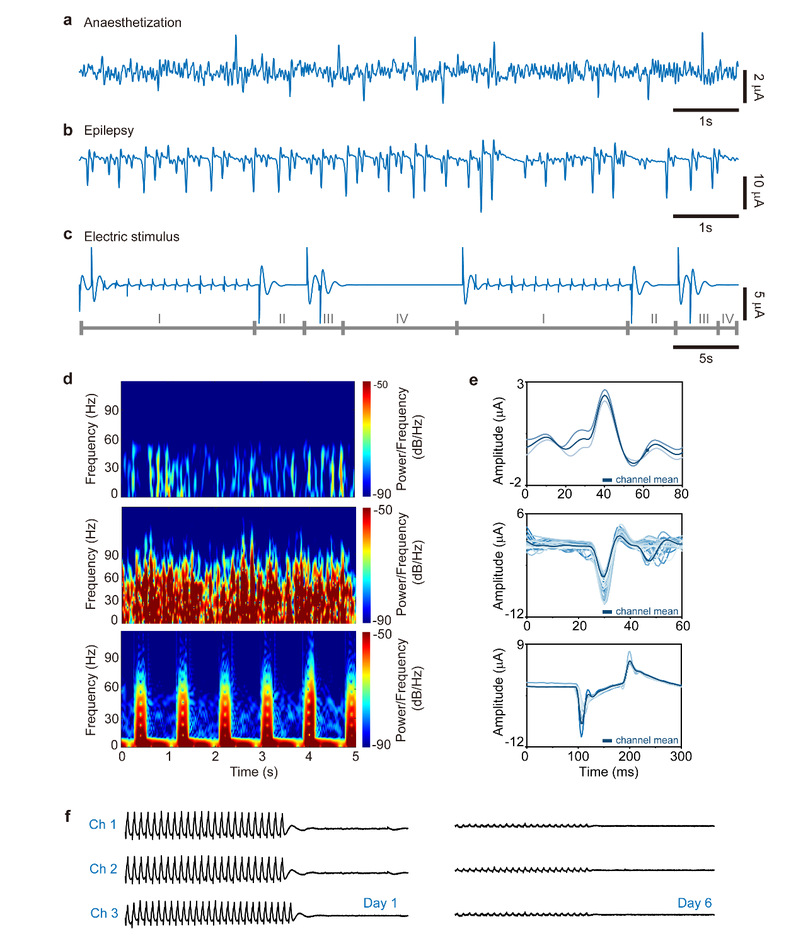
图5:Micro-ECoG信号的特征研究。(a)麻醉状态下典型的单通道脑皮质层电信号。(b)癫痫发作时典型的单通道脑皮质层电信号。(c)电刺激(1Hz, 3 V)下典型的单通道脑皮质层电信号。(d) 时域-频域-功率/频率分析结果,分别为麻醉状态(上图)、癫痫发作(中间图)和电刺激(下图)。(e) 麻醉状态(上图)、癫痫发作(中间图)和电刺激(下图)的相关特征诱发波形,其中深蓝色线条为通道平均值。(f) 可降解OECT神经接口在第1天和第6天记录的代表性micro-ECoG信号。
由于特有的组织形态共融的力学性能和理想的电化学性能,该OECT神经接口能无缝贴附在大脑皮层,用于高保真记录各种生理状态下的micro-ECoG信号。该神经接口的高时空分辨率,可用于绘制和阐明micro-ECoG信号的响应机制,在形式和功能上与以前的可生物降解神经接口器件有显著区别。在大鼠模型的麻醉、癫痫发作和电刺激下的演示,验证了该OECT神经接口在临床的巨大应用潜力,如用于围术期脑电活动监测,为认知功能和人工智能的研究提供器件基础。该研究成果为材料科学、电子学、神经科学的研究提供了基本的理解和器件设计方面的指导,为生物医学应用的植入式瞬态电子技术打下坚实的研究基础。
宋恩名,复旦大学光电研究院,青年研究员、博导。获得国家级海外优青、《麻省理工科技评论》创新35人亚太区、国家科技创新2030重大专项负责人(青年)、上海市青年科技引领计划35人(2022年榜单第一)。主要从事植入式柔性电子系统在脑机接口相关技术应用研究。以第一/通讯作者在Cell、NatureMaterials、NatureBiomedical Engineering、PNAS(3篇)、Advanced Materials、ACS Nano等学术期刊发表论文22篇。