研究背景
神经损伤修复是临床中常见且致残率较高的神经系统疾病,广泛存在于创伤及医源性损伤等场景中。尽管显微外科缝合、神经导管移植及电刺激治疗等手段已被应用于临床,但由于神经损伤区域空间受限、个体差异显著以及术后炎症反应复杂,现有治疗方式在精准调控、长期稳定性和微创性方面仍面临诸多挑战。尤其是传统神经接口多依赖刚性器件或有线连接,难以与柔软、动态变化的神经组织实现长期共形贴附,限制了其在慢性神经修复中的应用。随着柔性电子与生物可吸收材料的发展,能够在体内实现无线操控、形态自适应并在完成治疗后自然降解的新型神经接口,成为神经精准治疗领域的重要发展方向。然而,如何在保证器件力学顺应性的同时,实现对局灶性神经区域的稳定包覆及多模态治疗功能,仍是亟待解决的关键科学与工程问题。
文章概述
针对上述挑战,光电研究院宋恩名课题组提出并实现了自卷曲、生物可吸收的双稳态神经接口(self-wrapping bistable, SWB neural interface),用于精密神经损伤的无线多模态治疗。该器件基于应力梯度驱动的超薄SiNx双层结构,在触发后可由平面状态自发转变为三维卷曲结构,从而对不同直径的外周神经实现温和而稳定的包覆。在功能集成方面,该神经接口引入MXene光热层与药物负载模块,构建了无线近红外触发的光热治疗与药物释放相结合的多模态治疗体系,实现了对神经修复过程的时空精准调控。通过系统的力学建模、有限元仿真及在体实验,研究团队验证了器件自卷曲双稳态转变的可靠性、生物可吸收特性及其在大鼠坐骨神经损伤模型中的治疗效果。相关成果以“A self-wrapping, bioresorbable neural interface for wireless multimodal therapy of localized peripheral nerve injury”为题发表于 Proceedings of the National Academy of Sciences of the United States of America(PNAS)。复旦大学博士生刘鹏川、博士后周连杰、大连理工大学博士后徐典为论文第一作者,宋恩名与大连理工大学李锐教授为论文通讯作者。复旦大学光电研究院与未来信息创新学院为第一单位。

图文导读
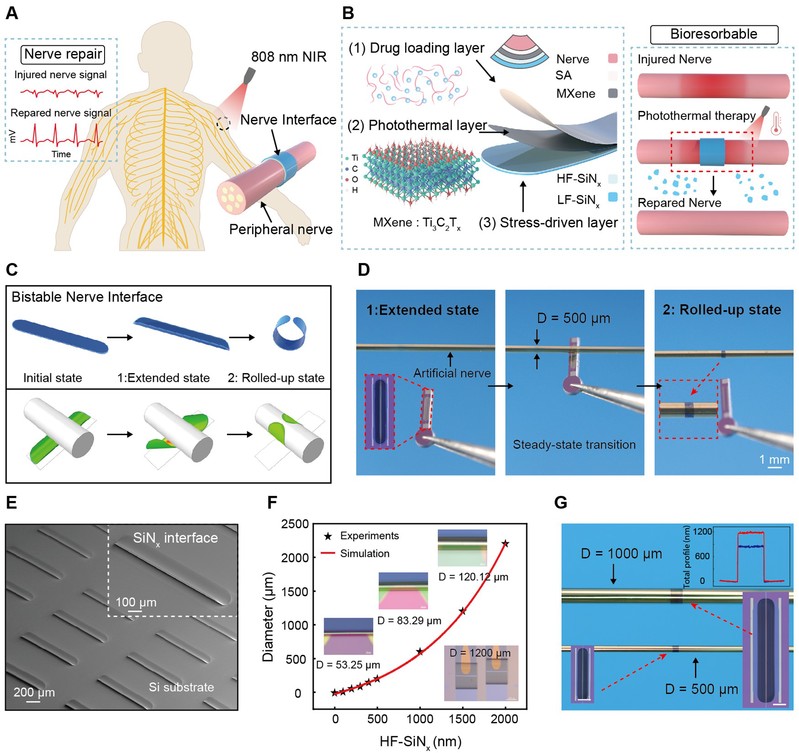
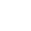
图1:自卷曲双稳态神经接口的结构设计与工作原理
研究团队构建了一种具备多功能集成能力的三层结构自卷曲双稳态神经接口,其层层功能协同,为损伤神经提供全时程的精准干预。为了实现广泛适配性,研究者系统调控SiNx双层的厚度与长宽比,实现了卷曲直径从15μm(适配细小神经束)到1 mm(适配坐骨神经)的跨尺度可编程调节能力。实验与有限元仿真一致表明:随着HF-SiNx厚度的增加,卷曲角度θ逐渐减小,从而可精准控制最终卷曲状态的曲率半径。这一策略不仅确保了器件的结构可调性与功能通用性,也为不同损伤场景下的精准治疗提供了可能。此外,相较于传统依赖外部力缝合或复杂支架结构的植入设备,该应力驱动式自卷曲机制具有更高的自适应性与操作简便性,无需缝线固定,即可实现稳定、顺应、非侵入式包覆神经表面,有效规避了因器械位移或机械不匹配所造成的二次损伤风险。
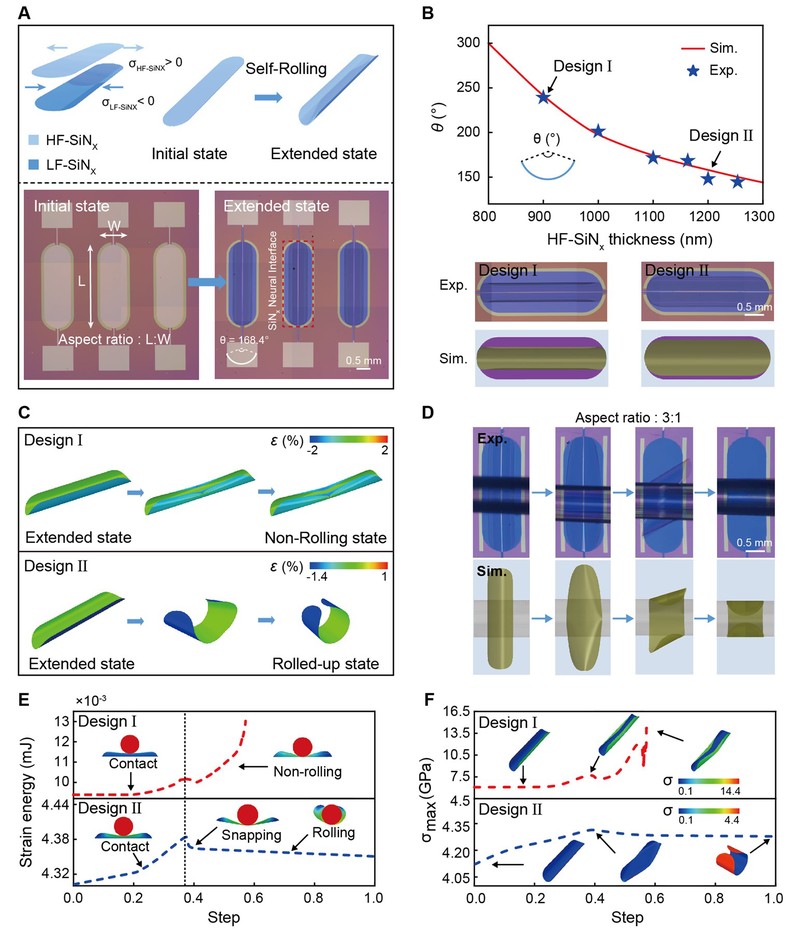
图2:双稳态力学行为模拟与实验验证
研究团队基于系统性的有限元分析与实验观测,深入揭示了该神经接口在应力驱动下从初始态→展开态→卷曲态的全过程转变机制,明确其属于典型的双稳态弹性系统。在结构设计上,器件采用上下两层SiNx构成应力驱动核心,其中上层HF-SiNx带有较高的拉应力(positive internal stress),下层LF-SiNx带有较弱的压应力(negative internal stress)。在初始构型中,器件被固定于基底呈平展态,内应力积累而未释放。释放后,自由态会首先转变为展开态(extended state),并在后续外部轻微机械触发下迅速跃迁至卷曲态(rolled-up state),形成稳定的三维包覆结构。综上所述,该器件的双稳态设计不仅提供了高度顺应的三维卷曲能力,还实现了结构可调、驱动可控、响应快速、材料安全、循环耐久等多重优异性能,为构建下一代智能化、动态响应的植入式神经接口奠定了坚实的力学基础。
图3:光热+药物多模态治疗功能验证
为了赋予该神经接口可控、非侵入、时空分辨可调的远程治疗能力,研究团队在器件中间层引入了二维材料Ti₃C₂Tx MXene构成光热响应单元。研究者系统测试了不同激光功率密度(100–150 mW/cm²)与不同照射时间(0–10s)条件下的温度响应曲线,实现了治疗温度范围从室温到50°C的高精度调控。更重要的是,研究团队进一步考虑了组织透射条件下的真实光热性能。在模拟生理条件下(如覆盖猪皮组织、厚度0–12.5 mm),通过Beer–Lambert定律测定808 nm激光的透射衰减系数(μ ≈ 0.503 mm⁻¹),发现即使在5 mm组织深度下仍可保留约6.7%的入射光强,对应温升可达6°C,足以驱动MXene层产生生理有效的热疗效应。该MXene光热单元在卷曲神经接口中不仅实现了快速响应、精准调控、良好组织透过性与高度生物兼容性,更与药物释放模块协同构成了时间上先药物后光热、空间上内药外热的多模态治疗结构,为神经再生提供了连续、协同、可控的治疗路径。
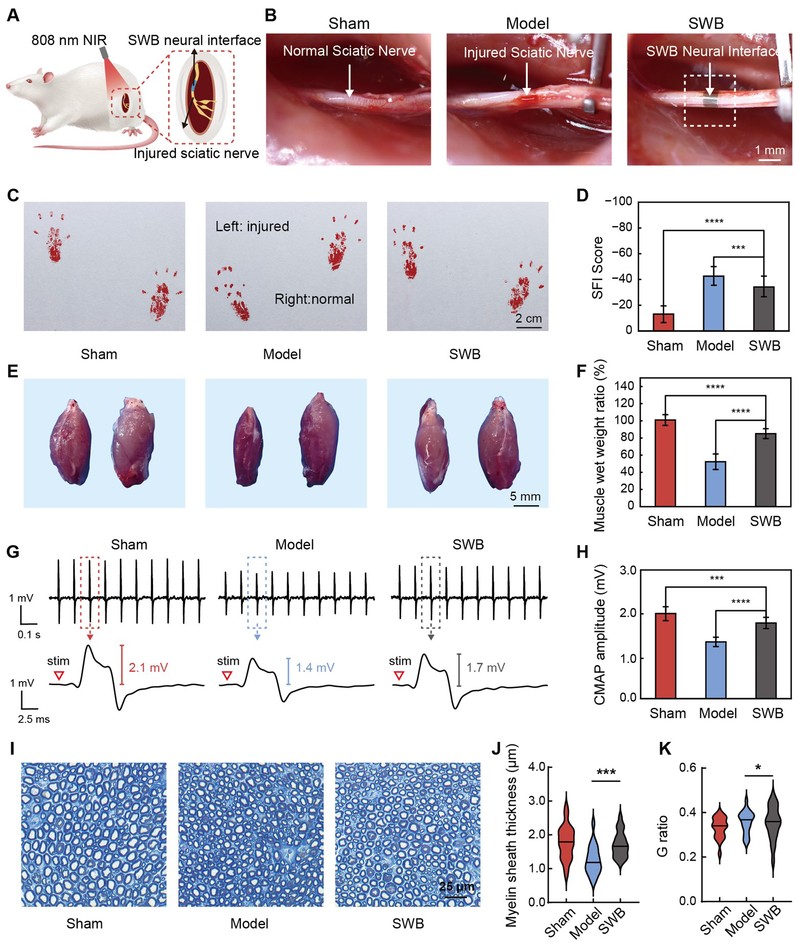
图4:在体治疗实验验证神经功能恢复
为系统验证所开发SWB神经接口在真实生理环境下的治疗效果,研究团队构建了大鼠坐骨神经钳夹损伤模型,并将自卷曲神经接口植入至损伤区域,进行为期4周的在体干预。干预期间,每周进行2次808 nm近红外激光照射(功率密度730 mW/cm²,每次5分钟),以激活器件内部的光热响应与药物协同释放。为了深入探讨药物释放与光热刺激两种治疗方式的作用机制与协同效果,研究者设计了四组对照实验:Control(无干预)、Drug(仅药物释放)、PT(仅光热刺激)、PT+Drug(联合治疗)。结果表明,尽管单一治疗方式均能在一定程度上促进神经恢复,但联合治疗组的SFI改善程度、肌肉保护效果及神经功能指标均最优,充分验证了本系统中“短期药物+长期光热”的时序协同治疗策略的有效性与优越性。
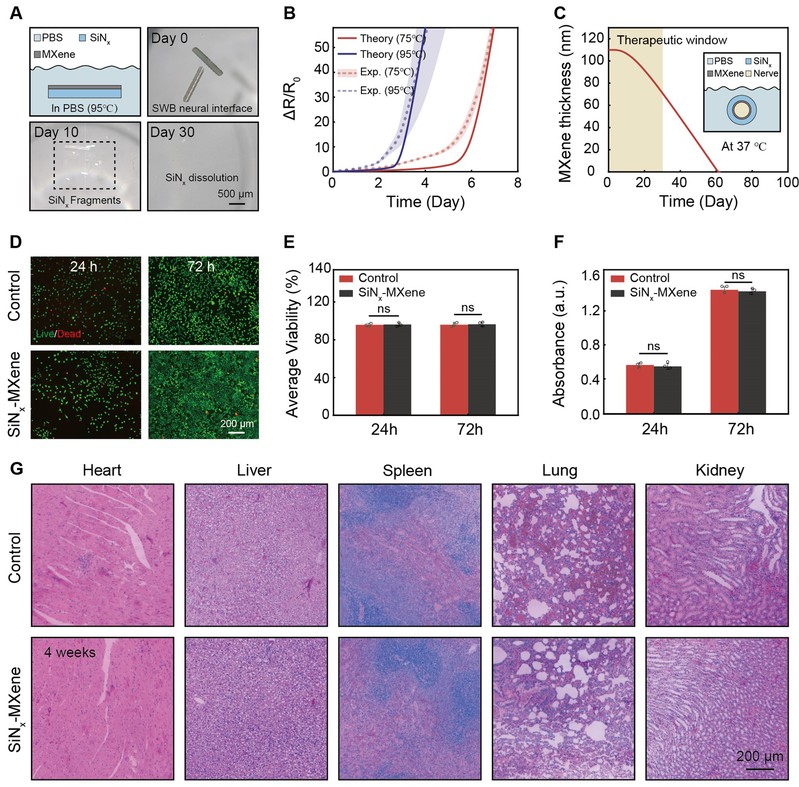
图5:器件的生物可吸收性与生物安全性验证
可吸收性是衡量植入式器件临床转化潜力的关键指标。为避免传统神经接口术后因材料残留而需二次手术取出的风险,本研究所开发的SWB神经接口在材料选择与结构设计阶段即充分考虑了其整体生物降解能力与体内代谢安全性。
研究团队通过磷酸盐缓冲液(PBS,pH 7.4)在95°C条件下的加速浸泡实验(模拟生理温度下约18倍的加速比例),对器件中关键材料-MXene层与SiNx层的溶解行为进行系统评估。为了进一步解析降解过程,研究团队构建了多层反应扩散模型,该模型不仅可准确预测MXene层在37°C下的降解周期,还揭示了SiNx保护层对降解速率的初期缓冲作用。研究者采用L929成纤维细胞与器件浸提液共培养(24 h与72 h),通过Calcein-AM/PI双染色与CCK-8活性检测评估器件对细胞增殖与存活的影响。实验结果说明MXene与SiNx材料的降解产物在浓度范围内对细胞无毒性,具备良好体外生物相容性。
小结
本研究提出了一种兼具自适应三维结构、生物可吸收特性及无线多模态治疗功能的新型神经接口,为局部外周神经损伤的精准治疗提供了全新的技术路径。该工作在结构设计、力学机制及治疗策略层面实现了有机融合,为下一代微创、智能神经接口的发展奠定了重要基础。
该工作得到了国家科技创新2030-脑科学与类脑研究重大专项(青年科学家)、国家自然科学基金委等项目的资助。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2521817123